*
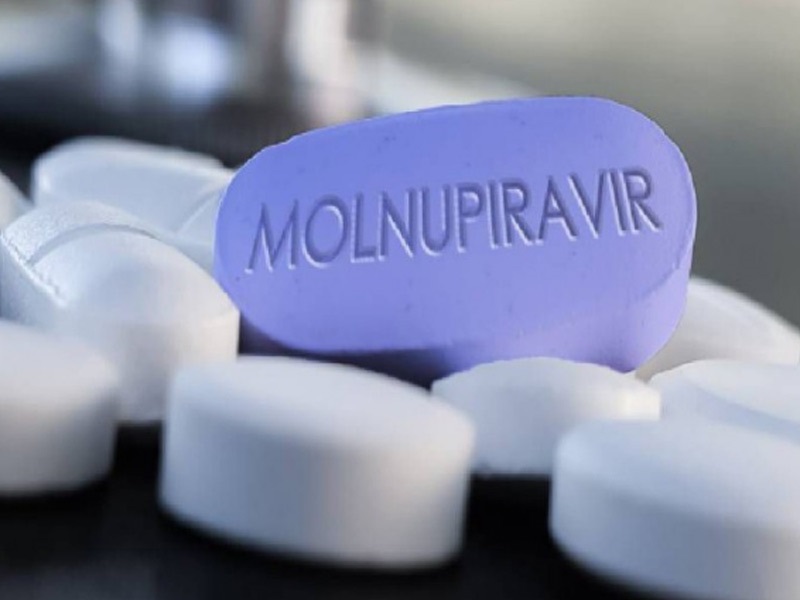
20/10/2021.- La multinacional alemana de productos farmacéuticos, químicos, y de biotecnología, Merck en Estados Unidos y MSD en Europa, acaba de anunciar que su medicamento “Molnupiravir” podría convertirse en la «primera» píldora antiviral para tratar el coronavirus.
Tras los resultados del ensayo clínico han decidido solicitar a la FDA la autorización para su medicamento que, según han hecho público hoy, reduce el riesgo de hospitalización o muerte a la mitad, cuando se administra a personas de alto riesgo y en los primeros momentos de la Covid-19.
El tratamiento podría convertirse en el primero de los muchos antivirales para el coronavirus que están en fase de ensayo clínico y que podrían convertirse en una nueva y poderosa herramienta para controlar la pandemia.
Así lo ha explicado al New York Times el Dr. Robert Shafer, especialista en enfermedades infecciosas y experto en terapia antiviral de la Universidad de Stanford:
– «Creo que este avance se traducirá en la salvación de miles de vidas en todo el mundo».
Otras dos píldoras están en camino
Pero «Molnupiravir» no será la única.
Se sabe que otras dos píldoras antivirales, una desarrollada por Pfizer y la otra por Atea Pharmaceuticals y Roche, están ya en las últimas fases de análisis de resultados, por lo que se espera que también puedan solicitar la autorización en los próximos meses.
La posología del medicamento de Merck (MSD), que está diseñado para detener la replicación del coronavirus, indica que se deben tomar cuatro cápsulas dos veces al día durante cinco días.
Y en el anuncio, el laboratorio ha explicado que una junta de expertos independiente que analiza los datos de su estudio recomendó que el ensayo se detuviera antes de lo previsto, ya que el beneficio del medicamento para los pacientes había resultado muy convincente.
La empresa añadió que la FDA (Administración de Alimentos y Medicamentos) había estado de acuerdo con esa decisión.
Los resultados del ensayo
El ensayo analizó datos hasta principios de agosto de 775 voluntarios en los Estados Unidos y en el extranjero.
Y los resultados hechos públicos por Merck (MSD) explican que en los voluntarios que recibieron el medicamento, el riesgo de ser hospitalizados o morir disminuyó en un 50% en comparación con los que recibieron píldoras de placebo. Y sin efectos secundarios preocupantes.
Además, un 7% de los voluntarios del grupo que recibieron el medicamento fueron hospitalizados, y ninguno murió. Gran dato en comparación con una tasa de hospitalización y muerte del 14%, incluidas ocho fallecimientos, en el grupo que recibió el placebo.
Anticuerpos monoclonales
Claro que en estos momentos no se puede decir que el «Molnupiravir» sea el tratamiento con mejores resultados de los conocidos hasta el momento. Porque la eficacia acreditada de la píldora de Merck (MSD) fue menor que la que se obtiene en los primeros días de la enfermedad con los tratamientos con anticuerpos monoclonales. Que han demostrado que reducen las hospitalizaciones y las muertes entre un 70 y un 85% en pacientes con Covid de alto riesgo.
Te puede interesar: Anticuerpos monoclonales ¿Qué es eso que los antivacunas sí están dispuestos a pincharse?
Ese «tratamiento» que imita los anticuerpos que el sistema inmunológico genera de forma natural para combatir el virus está teniendo mucha aceptación incluso entre los antivacunas. Pero es muy costoso (unos 2.100 dólares por inyección) y muy laborioso de administrar.
Por eso la viróloga e investigadora científica de la Organización de Vacunas y Enfermedades Infecciosas de la Universidad de Saskatchewan, Angela Rasmussen, dijo que las píldoras antivirales podrían tener un mayor impacto ya que tienen mayor capacidad de llegar a mucha gente.
La aceptación de esta magnífica noticia no se ha hecho esperar, y la prensa americana publica que el gobierno federal de Estados Unidos ya ha realizado pedidos por adelantado de 1,7 millones de dosis del fármaco de Merck (MSD), que tiene un precio de unos 700 dólares por paciente.
Merck (MSD), que está desarrollando la píldora con su socio Ridgeback Biotherapeutics de Miami, no ha dicho para qué pacientes planea pedirle a la FDA que apruebe el medicamento.
Es posible que lo haga inicialmente para los pacientes más delicados, es decir: las personas mayores y aquellos considerados de alto riesgo por sus dolencias previas.
Pero la idea es que más adelante, si los datos se van confirmando, se pueda administrar ampliamente.
Si se autoriza, el medicamento de Merck desbancaría al Remdesivir y podría ser considerado como el primer tratamiento antiviral para la Covid-19, vista la diferencia de efectividad.
Peter Bridge/ buscandorespuestas.lne.es